
金属螯合亲和层析介质(Ni QZT-DG FF)产品说明书
1. 产品简介
金属螯合亲和层析,又称固定化金属离子亲和层析(Immobilized metal ion affinity chromatography, IMAC)。该法利用蛋白质表面的某些氨基酸(如组氨酸、色氨酸、半胱氨酸等)和金属离子(Cu2+、Zn2+、Ni2+等过渡金属离子)发生特殊的相互作用的原理,从而实现蛋白质的分离。金属螯合亲和层析介质(Ni QZT-DG FF)是将金属螯合配基偶联到高交联琼脂糖微球上,并螯合金属离子Ni2+而形成的一种亲和层析介质。影响蛋白质/多肽与金属离子鳌合力大小的因素主要是蛋白质表面可结合的氨基酸(种类、数目和分布)、金属离子的种类和密度、层析条件(pH、盐的种类和浓度、添加剂等)。IMAC具有吸附容量大、选择性好、分辨率高、易于再生、成本较低等优点,广泛用于生物制药和生物工程下游蛋白质、核酸及多肽的分离纯化,尤其是组氨酸标记蛋白质的分离纯化。
2. 产品特性
Ni QZT-DG FF亲和介质具有良好的稳定性、生物相容性和溶剂相容性,这不仅有利于保持产品的生物活性和提高产品的收率,还有利于扩大层析操作条件的选择范围。Ni QZT-DG FF 亲和介质的理化性质和溶剂相容性分别如表1和表2所示。
表1. Ni QZT-DG FF的理化性质及特征参数
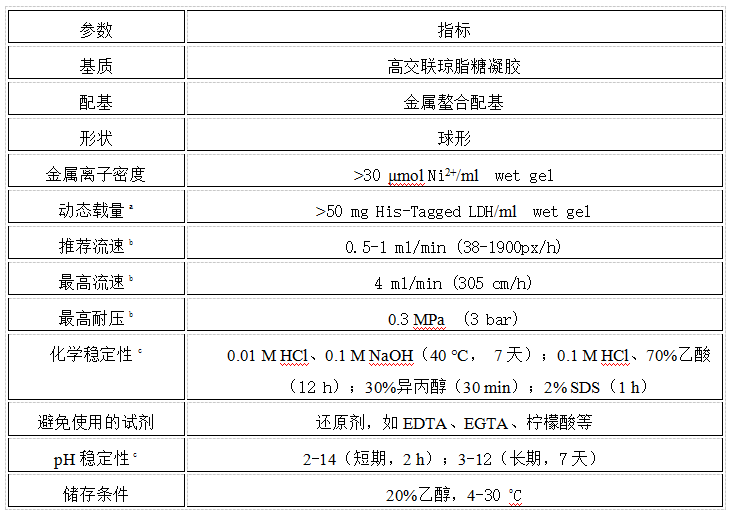
点击查看清晰大图
动态载量a:样品:2 mg/ml His-tagged LDH(Mr 140000)样品溶液;
1)预装柱(柱体积1ml)连在蛋白层析系统上,用Buffer A以0.5 mL/min的流速平衡至紫外稳定;
2) 以0.2 mL/min流速上样40 mL;
3)上样结束后用Buffer A以0.5-1 mL/min的流速淋洗至紫外降至基线;
4)用Buffer B以0.5-1mL/min洗脱,收集洗脱液,测定洗脱液体积及浓度,根据洗脱量计算介质的动态载量。
5)动态载量
平衡缓冲液:20 mM PB + 0.1 M NaCl + 50 mM 咪唑, pH 7.4;
洗脱缓冲液:20 mM PB + 0.1 M NaCl + 0.5 M 咪唑, pH 7.4;
注意:动态载量与蛋白种类和操作条件密切相关。
b:流动相为纯水,室温下操作,柱尺寸为10.0*1.0 cm I.D.,CV=7.85 ml。
c:未螯合Ni2+的介质。
表2 Ni QZT-DG FF介质和特定浓度试剂的相容性
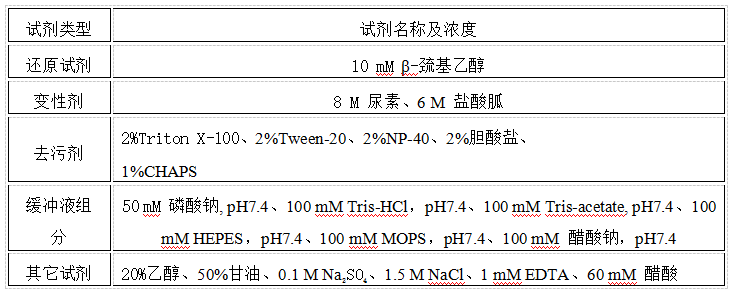
点击查看清晰大图
3. 应用
Ni QZT-DG FF广泛用于蛋白质、核酸及多肽,尤其是组氨酸标记蛋白质的分离纯化。金属螯合层析可采用重力柱、蠕动泵和层析系统等模式进行操作。以层析系统操作模式为例,层析操作通常包括装柱、螯合金属离子、平衡、进料、淋洗、洗脱、再生等步骤(具体操作条件以10.0 * 1.6 cm I.D.,CV=20.0 ml层析柱为例)。
3.1 装柱
(1)Ni QZT-DG FF介质通常在4 oC下保存于20%乙醇中,使用前先取出适量(22 ml介质)介质放置于烧杯中,用纯水置换掉20%的乙醇溶液,静置沉降后倒掉部分上清至凝胶浓度约为60%(匀浆液体积约为36 ml),搅拌均匀后备用(匀浆液温度尽量接近室温)。
(2)清洗层析柱及配件,排气泡后拧紧层析柱底端的出口,加入适量纯水至0.2-0.5 cm液位高度。
(3)用玻璃棒将介质匀浆液轻轻搅拌均匀(避免引入气泡),然后用玻璃棒导流将匀浆液沿着柱内壁一次性倒入柱内,尽量避免产生气泡。介质在层析柱内自由沉降后(30 min),连结好柱子顶端柱头(预先去除管道内及接口处的气泡)。
(4)打开泵,先用纯水以1 ml/min的流速压柱(10 min至胶面),然后再以2 ml/min的流速压柱,使柱床稳定,调节顶端柱头至胶面处。用2~3倍柱体积(CV)的缓冲液平衡柱子。
3.2 螯合金属离子
本介质可以根据需要,螯合不同的金属离子,如Cu2+、Ni2+或Zn2+等。Cu2+与蛋白质结合最强,Ni2+与蛋白质结合适中,Zn2+与蛋白质结合最弱,可根据实际需要选择。用户可选择购买螯合了相应金属离子的介质(出厂时一般以螯合Ni2+的形式提供,此时无需螯合金属离子步骤),也可自行螯合。
具体的鳌合方法如下:
(1)层析柱(未螯合或再生后)用5CV的纯水清洗;
(2)选择合适的金属离子(Cu2+、Zn2+、Ni2+、Co2+、Fe3+等),溶解在中性或弱酸性溶液中,浓度为用0.2 mol/L,0.45微米滤膜过滤后使用,其中Fe3+必须在低pH(3.0)下鳌合,以防止Fe3+产生沉淀;
(3)用5 CV的金属离子溶液上柱,鳌合金属离子;
(4)用5 CV以上的纯水清洗层析柱,去除游离的金属离子。
此外,也可以直接把清洗干净的介质和所要鳌合的金属离子溶液混合后在摇床上振荡过夜,鳌合金属离子,然后再装柱。
3.3 平衡
用5-10CV的平衡缓冲液平衡层析柱,至流出液电导和pH保持不变(与平衡液一致)。
实际操作中,一般选用中性/弱碱性(pH 7-8)的高盐(0.15-1.0 M NaCl或其它中性盐)缓冲液。其中常用磷酸盐缓冲体系,如20 mM PB+0.5 M NaCl, pH 7.4。对于结合力较强的带组氨酸标记的蛋白质,平衡缓冲液中可加入低浓度(5-50 mM)的咪唑(具体浓度需要根据实验现象进行优化)。
3.4 进料
样品缓冲液应尽可能与平衡液一致,固体样品可用平衡液溶解配制;低浓度样品溶液可用平衡液透析;高浓度样品溶液可用平衡液稀释。为了避免堵塞层析柱,样品应经离心或微滤处理。
为了减少杂蛋白在层析柱上的吸附,可在确保目标蛋白吸附的情况下适当增加样品缓冲液中的咪唑(具体浓度根据优化结果确定,并与平衡缓冲液的咪唑浓度保持一致)。
3.5 淋洗
上样完毕后继续用平衡缓冲液淋洗至基线。
3.6 洗脱
一般采用竞争试剂咪唑进行洗脱,并在洗脱缓冲液中加入一定浓度(0.15-1.0 M)的NaCl以抑制离子交换作用。洗脱缓冲液一般为20 mM PB + 0.5 M NaCl + 0.5 M咪唑,pH 7.4。可采用线性梯度或阶越式梯度洗脱(洗脱时所需的咪唑浓度与所纯化蛋白的结合强度有关,可通过洗脱浓度优化得到)。
对于包涵体蛋白,相应地可在平衡、上样和洗脱的缓冲液中加入8 M Urea或6 M Gua-HCl。洗脱后再对变性蛋白进行复性。
(备注:洗脱一般有两种方式:一是采用竞争试剂,如咪唑(0-0.5 M)、组氨酸(0-0.05 M)、氯化铵(0-2 M)等将蛋白质从柱子上置换下来;二是减小pH值,洗脱目标蛋白,大多数蛋白质在pH 4-6的范围内可被洗下来。用竞争试剂咪唑或减小pH值的方法洗脱蛋白质,金属离子仍结合在柱子上;若用竞争试剂组氨酸或氯化铵洗脱蛋白质,会将金属离子和蛋白质的复合物一起洗下来)。
3.7 再生
介质使用数次(约3-20次,具体与原料来源、样品体积等有关)后,或者螯合其它金属离子前,需要进行再生处理。首先用2-3 CV的纯水清洗层析柱,然后用5 CV的20 mM PB + 0.5 M NaCl +50 mM EDTA,pH 7.4淋洗柱子,再分别用5 CV的20 mM PB + 0.5 M NaCl,pH 7.40溶液和5 CV的纯水清洗柱子,去除柱上残留的EDTA。
螯合金属离子的操作按照“3.2”所述进行。
若有变性蛋白质或脂类物质在再生过程中未能有效去除,可用在位清洗(Cleaning in place, CIP)的方法去除。
3.8 原位清洗
为了避免不同样品间的相互干扰,或者当介质污染比较严重时(反压增加),需要对介质进行在位清洗。在位清洗前,需要预先去除介质上鳌合的金属离子。在位清洗时,可采用反向冲洗的方法。
(1)对于以离子键结合的蛋白,可用2-3 CV以上的2 M NaCl清洗,并用3 CV以上的纯水冲洗。
(2)对沉淀蛋白、以疏水性结合的蛋白或脂蛋白,可用2-3 CV的1M NaOH清洗(10-20 min),并用5-10 CV平衡液和3 CV以上的纯水冲洗。
(3)对疏水性结合的蛋白、脂蛋白和脂类物质,可用5-10 CV的70%乙醇或30%异丙醇清洗(15-20 min),并用5-10 CV的纯水冲洗。
此外,也可用2 CV含去污剂的碱性或酸性溶液清洗。如用0.1-0.5%的非离子去污剂+0.1 M乙酸冲洗1-2 h,并用5-10 CV的70%乙醇冲洗去除去污剂,然后用5-10 CV的纯水冲洗。
3.9 其它注意事项
在使用和保存柱子的时候,要避免柱子流干和密封不严,气泡进入。
4. 特色服务
(1)提供介质筛选及工艺开发的咨询。
(2)接受客户委托开发各种分离介质和分离工艺。
(3)按客户要求提供各种规格的预装柱。
(4)为客户提供专业的售前和售后服务。 |



