
1. 产品简介
Protein A能特异性地与抗体的Fc区结合,所以Protein A亲和介质可用于抗体(单抗和多抗)的分离纯化,经过一步亲和层析,即可从腹水、血清和培养液等样品中得到高纯度的抗体。Protein A QZT 4FF亲和介质以高流速琼脂糖凝胶为基质,以重组Protein A为配基,具有优异的物理化学稳定性,配基不易脱落,寿命长,使用方便,应用广泛。
2. 产品特性
Protein A QZT 4FF亲和介质的理化性质和产品特性如表1所示。
表1 Protein A QZT 4FF亲和介质的理化性质和产品特性
|
参数
|
指标
|
|
基质
|
4%交联琼脂糖凝胶
|
|
配基
|
r-Protein A
|
|
形状
|
球形
|
|
介质平均粒径
|
90 μm (45-165)
|
|
配基密度
|
6 mg Protein A/ml wet gel
|
|
动态载量
|
45-50 mg h-IgG/ml wet gel
|
|
最高流速(25℃)
|
450 cm/h
|
|
推荐流速
|
<150 cm/h
|
|
最高耐压
|
0.3 MPa (3 bar)
|
|
pH稳定性
|
3-10(长时间);2-11(短时间)
|
|
保存
|
4-8 oC(20%乙醇)
|
3. 使用方法
Protein A QZT 4FF广泛用于各种抗体的分离纯化。层析操作通常包括装柱、平衡、进料、淋洗、洗脱、再生等步骤。
平衡:用5-10CV的平衡缓冲液(20 mM PB+0.15 M NaCl,pH 7.0,添加适当浓度的NaCl抑制非特异性吸附)平衡层析柱,至流出液电导和pH不变(与平衡液一致)。
进料:样品缓冲液应尽可能与平衡液一致。固体样品可用平衡液溶解配制;低浓度样品溶液可用平衡液透析;高浓度样品溶液可用平衡液稀释。为了避免堵塞层析柱,样品应经离心或微滤(0.45 μm)处理。进料量根据介质的载量和料液中目标蛋白的含量计算。
淋洗:上样完毕后继续用平衡缓冲液淋洗至基线。
洗脱:用洗脱缓冲液(20 mM柠檬酸,pH 3.0;或0.1 M甘氨酸,pH 3.0;或20 mM乙酸钠,pH 3.0;具体洗脱条件与抗体的结合强度和稳定性密切相关,效果不好时应进行洗脱缓冲液(种类和pH或添加剂)的优化)洗脱,收集流出液。洗脱后,应立刻用碱性缓冲液(如1 M Tris/HCl, pH 9.0)将收集到的抗体溶液中和到抗体稳定的pH,避免抗体失活,维持抗体的生物活性。
再生、原位清洗:介质使用数次(5-10次,具体次数与原料的种类和来源及实验要求有关)后,需要对介质进行再生、在位清洗。
(1)用0.1 M的乙酸或0.1 M的乙酸/20%乙醇淋洗柱子3-5 CV,然后用缓冲液洗到中性即可重复使用;
(2)也可用0.05 M NaOH+1 M NaCl或6 M盐酸胍淋洗柱子3-5 CV,并用3-10 CV的纯水冲洗,然后用缓冲液洗到中性即可重复使用。
其它注意事项:在装柱、使用和保存柱子的时候,要避免柱子流干,气泡进入。
4. 具体应用
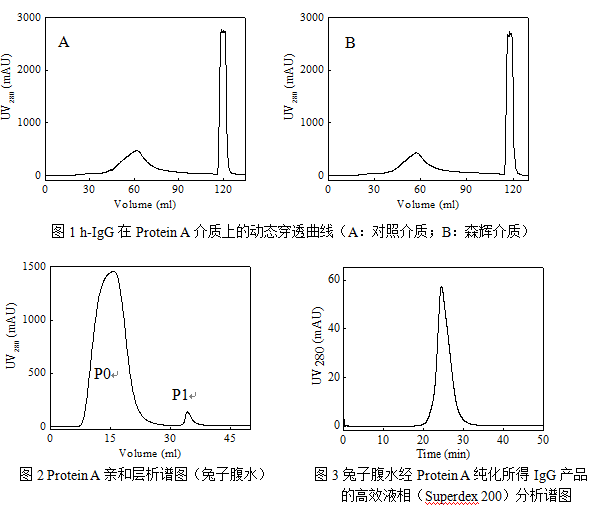
1 载量分析:利用人免疫球蛋白(血浆来源,纯度95%,3 mg/ml)进行载量分析(柱体积2 ml;Buffer A:20 mM PB+0.15 M NaCl,pH 7.0,Buffer B:0.1 M甘氨酸,pH 3.0;流速:0.5 ml/min;上样量:40 ml),层析谱图如图1(A:进口介质;B:本中心介质)所示,结果表明两种介质的层析谱图(穿透行为、洗脱峰)基本一致,无明显差异。洗脱峰的蛋白浓度分析结果表明,二者的载量相当,均在40-45 mg h-IgG/ml介质之间。
2 纯化效果分析:利用小鼠腹水(Buffer A稀释4倍)上样进行亲和层析,考察介质的分离纯化效果(柱体积2 ml;Buffer A:20 mM PB+0.15 M NaCl,pH 7.0,Buffer B:20 mM柠檬酸,pH 3.0;流速:0.5 ml/min;上样量:4 ml),层析谱图如图2所示,纯度分析结果表明,经过一步亲和层析,即可得到纯度95%以上的IgG。
5 特色服务
(1)提供介质筛选及工艺开发的咨询。
(2)接受客户委托开发各种分离介质和分离工艺。
(3)按客户要求提供各种规格的预装柱。
(4)为客户提供专业的售前和售后服务。 |



